Mundo
PFIZER PIDE AUTORIZACIÓN PARA SUMINISTRAR CON URGENCIA SU VACUNA
-
 ViralHace 4 años
ViralHace 4 añosMAESTRO CALIFICA LOS EXÁMENES DE SUS ALUMNOS HORAS ANTES DE MORIR
-

 ViralHace 4 años
ViralHace 4 añosZARA LANZA SUÉTER SÓLO CON MANGAS Y CREA POLÉMICA
-

 ViralHace 4 años
ViralHace 4 años“SÉ QUE ME VAS A MATAR Y TE AMO”: HOMBRE ASESINA A SU MADRE Y BAILA CON SU HERMANA JUNTO AL CADÁVER
-

 ViralHace 4 años
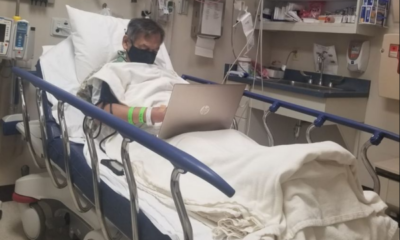
ViralHace 4 años“HICIMOS TODO LO QUE PUDIMOS, TE LO JURO”, DICEN A SU PADRE QUE FALLECIÓ POR COVID; NO LO ACEPTARON EN NINGÚN HOSPITAL
-

 NacionalHace 4 años
NacionalHace 4 añosASÍ PUEDES SABER CUÁNTOS PUNTOS TIENES EN INFONAVIT
-
 UncategorizedHace 4 años
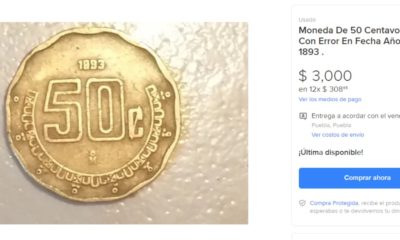
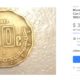
UncategorizedHace 4 añosMONEDAS DE 50 CENTAVOS SE VENDEN EN MILES DE PESOS
-

 COVID-19Hace 4 años
COVID-19Hace 4 añosDESCUBREN MEDICAMENTO QUE EVITA QUE EL CORONAVIRUS SE PROPAGUE EN 24 HORAS
-

 ViralHace 4 años
ViralHace 4 añosSE DESFIGURA LA CARA TRAS APRETARSE UN GRANO











You must be logged in to post a comment Login